pH là một chỉ số quan trọng, phản ánh tính axit, bazơ (kiềm) của một dung dịch. Việc hiểu rõ và áp dụng Công Thức Tính Nồng độ H+ (ion hydro) là vô cùng cần thiết trong nhiều lĩnh vực như hóa học, sinh học, y học, nông nghiệp và đặc biệt là trong xử lý nước. Bài viết này sẽ cung cấp một cái nhìn toàn diện về công thức tính pH, các trường hợp áp dụng cụ thể và các công cụ hỗ trợ đo pH chính xác.
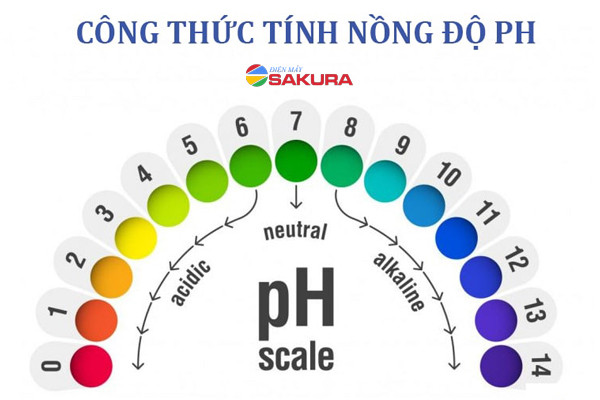
Hình ảnh minh họa thang đo pH, giúp dễ dàng hình dung mức độ axit và kiềm của các dung dịch khác nhau, từ đó ứng dụng tốt hơn các công thức tính nồng độ H+.
Các Công Thức Tính pH Cơ Bản
Độ pH được định nghĩa là logarit âm cơ số 10 của nồng độ ion H+ trong dung dịch. Điều này có nghĩa là:
pH = -log[H+]
Trong đó:
- [H+]: Nồng độ mol/l của ion hydro (H+) trong dung dịch.
- log: Logarit cơ số 10.
Từ công thức này, ta có thể suy ra công thức tính nồng độ H+ khi biết pH:
[H+] = 10^(-pH)
Đối với dung dịch bazơ (kiềm), ta sử dụng mối liên hệ giữa pH và pOH:
pH + pOH = 14
Trong đó:
pOH = -log[OH-]
Vậy, công thức tính pH cho dung dịch bazơ là:
pH = 14 – pOH = 14 + log[OH-]
Và công thức tính nồng độ H+ từ nồng độ OH-:
[H+] = Kw / [OH-]
Trong đó:
- Kw: Tích số ion của nước, có giá trị khoảng 1.0 x 10^-14 ở 25°C.
Công Thức Tính pH Trong Các Trường Hợp Cụ Thể
Việc áp dụng công thức tính pH sẽ có sự khác biệt tùy thuộc vào loại dung dịch (axit mạnh, axit yếu, bazơ mạnh, bazơ yếu, muối, dung dịch đệm).
Tính pH cho Axit
-
Axit mạnh: Axit mạnh phân ly hoàn toàn trong nước. Do đó, nồng độ H+ bằng nồng độ axit.
pH = -log(Ca)
Trong đó Ca là nồng độ của axit mạnh.
-
Axit yếu: Axit yếu chỉ phân ly một phần trong nước. Do đó, cần sử dụng hằng số axit Ka để tính pH.
pH = -1/2 log(Ka Ca)
Hoặc
*pH = 1/2 (pKa – logCa)**
Trong đó Ka là hằng số phân ly axit và pKa = -logKa.
Tính pH cho Bazơ (Kiềm)
-
Bazơ mạnh: Bazơ mạnh phân ly hoàn toàn trong nước. Do đó, nồng độ OH- bằng nồng độ bazơ.
pH = 14 + log(Cb)
Trong đó Cb là nồng độ của bazơ mạnh.
-
Bazơ yếu: Bazơ yếu chỉ phân ly một phần trong nước. Do đó, cần sử dụng hằng số bazơ Kb để tính pH.
pH = 14 + 1/2 log(Kb Cb)
Hoặc
*pH = 14 + 1/2 (pKb – logCb)**
Trong đó Kb là hằng số phân ly bazơ và pKb = -logKb.
Tính pH cho Dung Dịch Muối
Việc tính pH cho dung dịch muối phức tạp hơn và phụ thuộc vào loại muối:
- Muối tạo bởi axit mạnh và bazơ mạnh: pH ≈ 7 (trung tính).
- Muối tạo bởi axit mạnh và bazơ yếu: pH < 7 (axit). Sử dụng công thức tính pH tương tự như axit yếu, nhưng cần tính đến hằng số phân ly của cation kim loại.
- Muối tạo bởi axit yếu và bazơ mạnh: pH > 7 (bazơ). Sử dụng công thức tính pH tương tự như bazơ yếu, nhưng cần tính đến hằng số phân ly của anion gốc axit.
- Muối tạo bởi axit yếu và bazơ yếu: pH phụ thuộc vào tương quan giữa Ka và Kb của axit và bazơ tương ứng.
Tính pH cho Dung Dịch Đệm
Dung dịch đệm là hỗn hợp của axit yếu và bazơ liên hợp của nó, hoặc bazơ yếu và axit liên hợp của nó. Dung dịch đệm có khả năng duy trì pH ổn định khi thêm một lượng nhỏ axit hoặc bazơ.
Hình ảnh trực quan về cơ chế hoạt động của dung dịch đệm, giúp người đọc hiểu rõ hơn về cách các ion H+ và OH- được trung hòa để giữ pH ổn định.
Công thức Henderson-Hasselbalch được sử dụng để tính pH của dung dịch đệm:
pH = pKa + log([A-]/[HA])
Trong đó:
- pKa = -logKa (Ka là hằng số phân ly axit).
- [A-]: Nồng độ của bazơ liên hợp.
- [HA]: Nồng độ của axit yếu.
Các Công Cụ Đo Nồng Độ pH
Để xác định nồng độ pH một cách chính xác, có nhiều công cụ khác nhau được sử dụng:
- Giấy quỳ tím: Phương pháp đơn giản, nhanh chóng, cho biết tính axit/bazơ.
Hình ảnh minh họa trực quan cách sử dụng giấy quỳ tím và so sánh màu sắc để xác định khoảng pH của dung dịch, phù hợp cho việc kiểm tra nhanh.
- Bộ test thử nước: Thường dùng trong kiểm tra nước hồ bơi, cho biết pH và nồng độ clo.
- Máy đo pH điện tử: Cho kết quả chính xác, nhanh chóng, dễ sử dụng.
- Chất chỉ thị pH: Thay đổi màu sắc tùy theo pH, so sánh với bảng màu để xác định pH.
Hiểu rõ công thức tính nồng độ H+ và cách áp dụng trong các trường hợp cụ thể là kiến thức quan trọng giúp bạn giải quyết nhiều vấn đề trong thực tế. Việc sử dụng các công cụ đo pH phù hợp cũng góp phần đảm bảo độ chính xác của kết quả.