Axit nitric (HNO3) là một hợp chất hóa học quan trọng với nhiều ứng dụng trong công nghiệp, nông nghiệp và phòng thí nghiệm. Bài viết này sẽ cung cấp một cái nhìn toàn diện về Phương Trình Hno3, bao gồm tính chất, điều chế, ứng dụng và các lưu ý an toàn khi sử dụng.
Axit Nitric (HNO3) Là Gì?
Axit nitric là một hợp chất vô cơ có công thức hóa học HNO3, là một axit mạnh, có tính ăn mòn cao và là một chất oxy hóa mạnh. Nó còn được gọi là dung dịch nitrat hydro.
Công thức phân tử: HNO3
Cấu tạo phân tử:
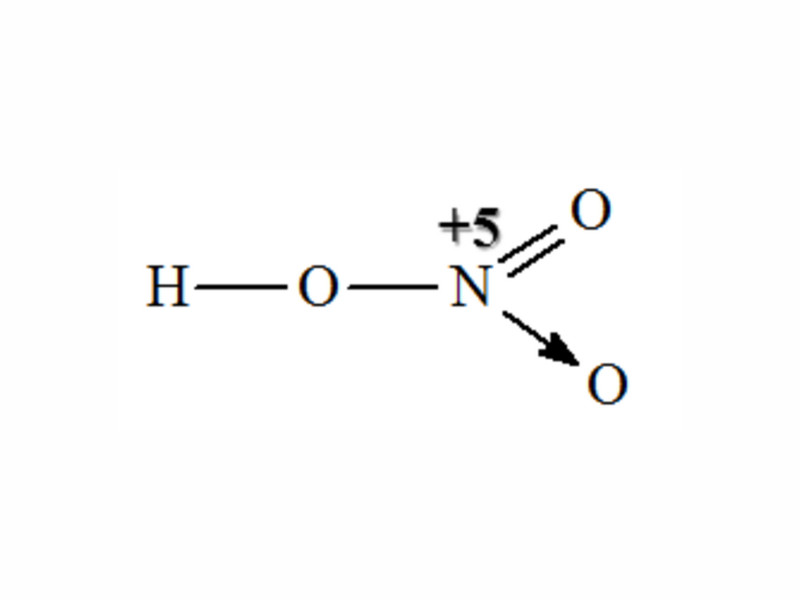 Cấu tạo phân tử Axit nitric với liên kết cho nhận giữa N và O, thể hiện số oxi hóa +5 của Nitơ.
Cấu tạo phân tử Axit nitric với liên kết cho nhận giữa N và O, thể hiện số oxi hóa +5 của Nitơ.
Tính Chất Vật Lý Của Axit Nitric (HNO3)
- Trạng thái: Chất lỏng không màu (khi tinh khiết), bốc khói mạnh trong không khí ẩm. Dung dịch đậm đặc có thể có màu vàng nhạt do sự phân hủy tạo thành NO2.
- Độc tính: Rất độc, có tính ăn mòn và gây cháy.
- Độ tan: Tan hoàn toàn trong nước.
- Nhiệt độ sôi: 83°C
- Nhiệt độ đông đặc: -42°C
Tính Chất Hóa Học Của Axit Nitric (HNO3)
Axit nitric là một axit mạnh và có tính oxy hóa cao, thể hiện qua các phản ứng sau:
Tính Axit Mạnh
-
Phân ly hoàn toàn trong dung dịch:
HNO3 → H+ + NO3-
-
Tác dụng với oxit bazơ, bazơ và muối của axit yếu hơn:
CuO + 2HNO3 → Cu(NO3)2 + H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Tính Oxi Hóa Mạnh
Tính oxi hóa của HNO3 phụ thuộc vào nồng độ và bản chất của chất phản ứng. Sản phẩm khử có thể là NO2, NO, N2O, N2 hoặc NH4NO3.
Tác dụng với kim loại
-
Với kim loại (trừ Au và Pt): Kim loại bị oxi hóa lên mức cao nhất. Sản phẩm khử phụ thuộc vào nồng độ HNO3.
- HNO3 đặc:
Cu + 4HNO3 (đặc) → Cu(NO3)2 + 2NO2 + 2H2O - HNO3 loãng:
3Cu + 8HNO3 (loãng) → 3Cu(NO3)2 + 2NO + 4H2O
Lưu ý: Al, Fe, Cr bị thụ động hóa trong HNO3 đặc nguội.
Phản ứng giữa đồng và axit nitric đặc tạo ra khí nitơ đioxit (NO2), có màu nâu đỏ.
- HNO3 đặc:
Tác dụng với phi kim
-
Với phi kim (C, S, P…): Phi kim bị oxi hóa lên mức cao nhất.
C + 4HNO3 (đặc) → CO2 + 4NO2 + 2H2O
S + 6HNO3 (đặc) → H2SO4 + 6NO2 + 2H2O
Tác dụng với hợp chất
-
Oxi hóa nhiều hợp chất vô cơ và hữu cơ:
3H2S + 2HNO3 → 3S + 2NO + 4H2O
PbS + 8HNO3 → PbSO4 + 8NO2 + 4H2O
Các chất hữu cơ như vải, giấy, mùn cưa… có thể bị phá hủy hoặc bốc cháy.
Điều Chế Axit Nitric (HNO3)
Trong Phòng Thí Nghiệm
-
Từ muối nitrat và axit sunfuric đặc:
NaNO3 (rắn) + H2SO4 (đặc) → HNO3 + NaHSO4 (điều kiện: nhiệt độ)
Trong Công Nghiệp
-
Quy trình Ostwald (3 giai đoạn):
-
Oxi hóa amoniac:
4NH3 + 5O2 → 4NO + 6H2O (điều kiện: 850-900°C, xúc tác Pt)
-
Oxi hóa nitơ monoxide:
2NO + O2 → 2NO2
-
Hấp thụ nitơ dioxide vào nước:
4NO2 + O2 + 2H2O → 4HNO3
Sơ đồ minh họa quy trình Ostwald trong sản xuất công nghiệp axit nitric.
-
Ứng Dụng Của Axit Nitric (HNO3)
-
Sản xuất phân bón: NH4NO3, Ca(NO3)2,…
-
Sản xuất thuốc nổ: TNT, nitroglycerin, RDX,…
-
Sản xuất hóa chất: Nitrobenzen, anilin,…
-
Trong luyện kim: Tẩy rửa, khắc kim loại.
-
Trong phòng thí nghiệm: Thuốc thử, phân tích.
Ứng dụng của axit nitric trong sản xuất phân bón giúp tăng năng suất cây trồng.
Lưu Ý An Toàn Khi Sử Dụng Axit Nitric (HNO3)
- Axit nitric là chất ăn mòn mạnh, cần trang bị đầy đủ bảo hộ lao động (kính, găng tay, quần áo bảo hộ) khi tiếp xúc.
- Khi pha loãng, luôn đổ từ từ axit vào nước, không làm ngược lại.
- Bảo quản trong thùng chứa kín, tối màu, tránh ánh sáng trực tiếp và nhiệt độ cao.
- Khi bị axit nitric bắn vào da hoặc mắt, rửa ngay bằng nhiều nước sạch và đến cơ sở y tế gần nhất.
Kết Luận
Axit nitric (HNO3) là một hợp chất hóa học quan trọng với nhiều ứng dụng rộng rãi. Hiểu rõ về tính chất, điều chế, ứng dụng và các biện pháp an toàn khi sử dụng axit nitric là rất cần thiết để đảm bảo an toàn và hiệu quả trong công việc và học tập.
