Liên kết hóa học là nền tảng để hiểu về cấu trúc và tính chất của các hợp chất. Trong số đó, liên kết ion và liên kết cộng hóa trị là hai loại liên kết quan trọng nhất. Bài viết này sẽ đi sâu vào cách phân biệt hai loại liên kết này, giúp bạn nắm vững kiến thức và áp dụng vào giải bài tập hiệu quả.
1. Liên Kết Cộng Hóa Trị là Gì?
Liên kết cộng hóa trị (LKCHT) là liên kết được hình thành giữa hai nguyên tử thông qua việc chia sẻ một hoặc nhiều cặp electron. Mục đích của việc chia sẻ này là để cả hai nguyên tử đều đạt được cấu hình electron bền vững, tương tự như cấu hình của các khí hiếm.
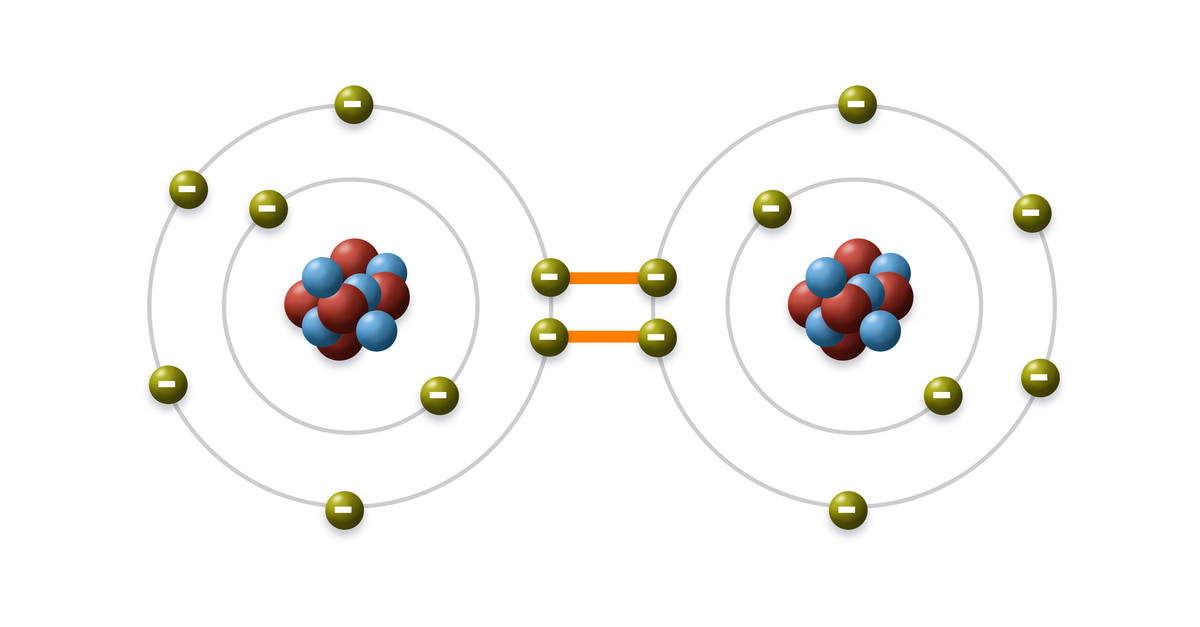
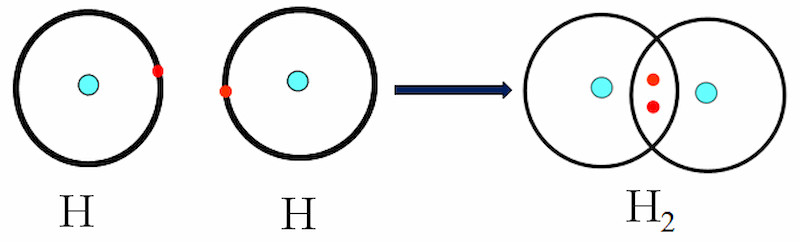
Ví dụ, trong phân tử hydro (H2), mỗi nguyên tử hydro góp một electron để tạo thành một cặp electron chung, hình thành liên kết cộng hóa trị.
2. Sự Hình Thành Liên Kết Cộng Hóa Trị
2.1. Trong Phân Tử Đơn Chất
-
Phân tử Hydro (H2): Mỗi nguyên tử H có 1 electron lớp ngoài cùng. Khi hai nguyên tử H liên kết, chúng chia sẻ một cặp electron để đạt cấu hình bền vững của khí hiếm Heli (He).
-
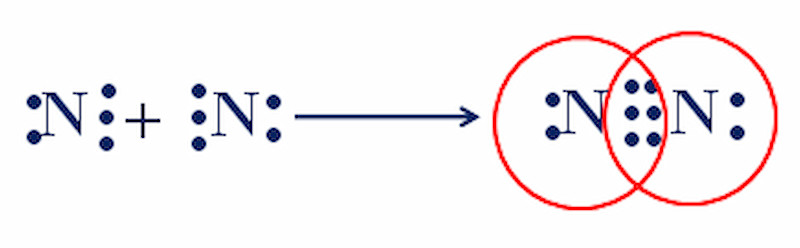
Phân tử Nitrogen (N2): Mỗi nguyên tử N có 5 electron lớp ngoài cùng. Chúng chia sẻ 3 cặp electron để đạt cấu hình bền vững của khí hiếm Neon (Ne). Liên kết này là liên kết ba, rất bền vững.
2.2. Trong Phân Tử Hợp Chất
-
Phân tử Hydro Clorua (HCl): Nguyên tử H và Cl cùng góp 1 electron tạo thành 1 cặp electron dùng chung. Do độ âm điện của Cl lớn hơn H, cặp electron lệch về phía Cl, tạo thành liên kết cộng hóa trị phân cực.
-
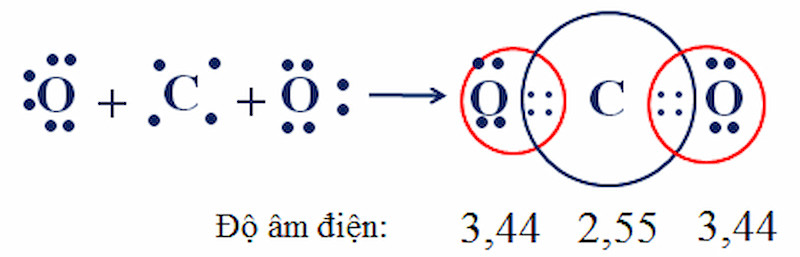
Phân tử Carbon Dioxide (CO2): Nguyên tử C nằm giữa hai nguyên tử O, góp 2 electron với mỗi nguyên tử O, tạo thành 2 liên kết đôi. Mặc dù liên kết C=O phân cực, nhưng do cấu trúc thẳng, CO2 là phân tử không phân cực.
3. Các Loại Liên Kết Cộng Hóa Trị
- Liên kết cộng hóa trị có cực: Cặp electron dùng chung lệch về một phía của nguyên tử có độ âm điện lớn hơn. Ví dụ: H-Cl, H2O.
- Liên kết cộng hóa trị không cực: Cặp electron dùng chung nằm giữa hai nguyên tử. Ví dụ: H-H, O=O.
- Liên kết đơn, đôi, ba: Dựa vào số lượng cặp electron dùng chung (1, 2 hoặc 3 cặp).
4. Liên Kết Ion là Gì?
Liên kết ion là liên kết được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Quá trình hình thành liên kết ion bao gồm sự chuyển electron từ một nguyên tử (thường là kim loại) sang một nguyên tử khác (thường là phi kim), tạo thành ion dương (cation) và ion âm (anion).
5. Phân Biệt Liên Kết Cộng Hóa Trị và Liên Kết Ion
Để phân biệt hai loại liên kết này, ta dựa vào các yếu tố sau:
| Đặc điểm | Liên kết ion | Liên kết cộng hóa trị |
|---|---|---|
| Bản chất | Lực hút tĩnh điện giữa các ion trái dấu | Sự chia sẻ electron giữa các nguyên tử |
| Sự hình thành | Chuyển electron từ kim loại sang phi kim | Chia sẻ electron giữa hai phi kim hoặc hai nguyên tử gần giống nhau về độ âm điện |
| Độ âm điện | Hiệu độ âm điện lớn (thường >= 1.7) | Hiệu độ âm điện nhỏ (thường < 1.7) |
| Tính chất vật lý | Thường là chất rắn, nhiệt độ nóng chảy và sôi cao | Có thể là chất rắn, lỏng hoặc khí, nhiệt độ nóng chảy và sôi thường thấp hơn |
| Khả năng dẫn điện | Dẫn điện tốt khi nóng chảy hoặc hòa tan trong nước | Thường không dẫn điện |
6. Mối Liên Hệ Giữa Các Loại Liên Kết
Liên kết ion và liên kết cộng hóa trị là hai thái cực của liên kết hóa học. Liên kết ion có thể được coi là một trường hợp đặc biệt của liên kết cộng hóa trị, khi cặp electron dùng chung bị lệch hoàn toàn về một nguyên tử.
- Liên kết cộng hóa trị không cực: Cặp electron chia đều.
- Liên kết cộng hóa trị có cực: Cặp electron lệch về một phía.
- Liên kết ion: Cặp electron lệch hoàn toàn về một phía.
7. Hiệu Độ Âm Điện và Dự Đoán Loại Liên Kết
Hiệu độ âm điện giữa hai nguyên tử có thể giúp dự đoán loại liên kết:
- 0 – 0.4: Liên kết cộng hóa trị không cực.
- 0.4 – 1.7: Liên kết cộng hóa trị có cực.
- >= 1.7: Liên kết ion.
Tuy nhiên, đây chỉ là một quy tắc tương đối, và cần xem xét thêm các yếu tố khác để đưa ra kết luận chính xác.
8. Bài Tập Vận Dụng
Ví dụ: Xác định loại liên kết trong các hợp chất sau: NaCl, H2O, CO2.
- NaCl: Na (0.93), Cl (3.16). Hiệu độ âm điện = 3.16 – 0.93 = 2.23 >= 1.7. Liên kết ion.
- H2O: H (2.20), O (3.44). Hiệu độ âm điện = 3.44 – 2.20 = 1.24 < 1.7. Liên kết cộng hóa trị có cực.
- CO2: C (2.55), O (3.44). Hiệu độ âm điện = 3.44 – 2.55 = 0.89 < 1.7. Liên kết cộng hóa trị có cực (nhưng phân tử không cực do cấu trúc).
Nắm vững kiến thức về liên kết ion và liên kết cộng hóa trị là chìa khóa để hiểu sâu sắc về hóa học. Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích và giúp bạn tự tin hơn trong việc giải quyết các bài tập liên quan.
