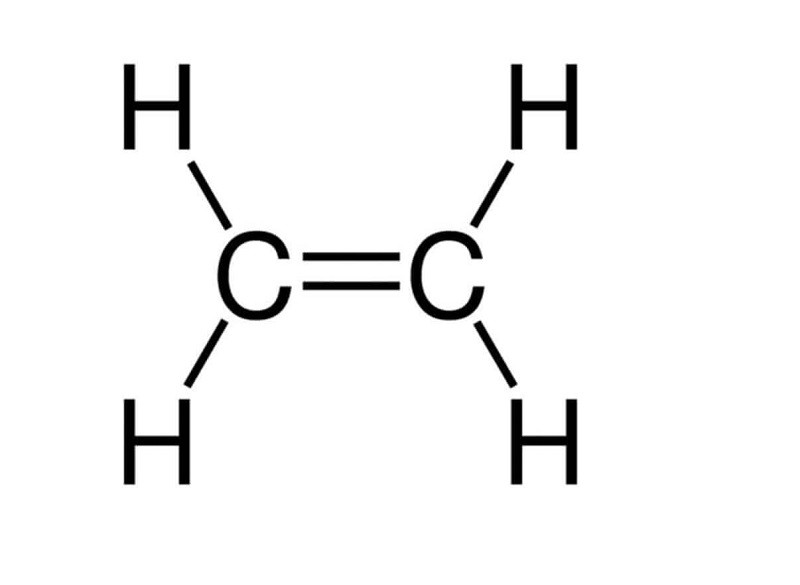
Etilen (C2H4), hay còn gọi là ethylene, là một hydrocacbon thuộc loại anken đơn giản nhất, đóng vai trò quan trọng trong nhiều ngành công nghiệp và đời sống. Đặc biệt, Ctct Etilen quyết định các tính chất hóa học đặc trưng của nó, mở ra vô số ứng dụng thực tiễn.
Etilen có công thức hóa học là C2H4 hoặc CH2=CH2.
- Công thức phân tử: C2H4
- Phân tử khối: 28
Trong công thức cấu tạo của etilen, ta thấy có một liên kết đôi (C=C) giữa hai nguyên tử carbon. Liên kết này gồm một liên kết sigma (σ) bền và một liên kết pi (π) kém bền. Chính liên kết pi này tạo nên tính chất hóa học đặc trưng của etilen. Các hydrocacbon mạch hở có một liên kết đôi trong phân tử như etilen được gọi là anken, có công thức chung là CnH2n (n ≥ 2).
Cấu trúc và Liên kết trong Etilen (C2H4)
Phân tử etilen (C2H4) có cấu trúc phẳng, với các nguyên tử nằm trên cùng một mặt phẳng. Mỗi nguyên tử carbon liên kết với hai nguyên tử hydro bằng liên kết sigma (σ) và liên kết với nguyên tử carbon còn lại bằng một liên kết sigma (σ) và một liên kết pi (π). Như vậy, mỗi phân tử C2H4 có 4 liên kết đơn C-H và 1 liên kết đôi C=C, trong đó liên kết C=C quyết định ctct etilen.
- Liên kết C-H là liên kết cộng hóa trị không phân cực.
- Liên kết C=C là liên kết cộng hóa trị, trong đó liên kết π kém bền và dễ bị phá vỡ trong các phản ứng hóa học.
Tính chất vật lý của Etilen
Etilen là chất khí không màu, không mùi, nhẹ hơn không khí (d = 28/29), và ít tan trong nước. Nó tan nhiều hơn trong các dung môi hữu cơ như ete. Khí etilen dễ bắt cháy và khi cháy tạo ra ngọn lửa sáng.
Để nhận biết etilen, người ta thường sử dụng dung dịch brom hoặc dung dịch kali pemanganat (thuốc tím). Etilen làm mất màu các dung dịch này do phản ứng cộng vào liên kết đôi.
Tính chất hóa học của Etilen và các Phản ứng Quan Trọng
Ctct etilen với liên kết đôi C=C обусловливает tính chất hóa học đặc trưng của nó. Etilen dễ dàng tham gia các phản ứng cộng, phản ứng trùng hợp và phản ứng oxi hóa.
Phản ứng cháy (Oxi hóa hoàn toàn)
Etilen cháy hoàn toàn trong oxi tạo thành khí cacbonic (CO2) và nước (H2O), đồng thời tỏa nhiều nhiệt:
C2H4 + 3O2 → 2CO2 + 2H2O (nhiệt độ)
Phản ứng cộng
Do có liên kết pi kém bền, etilen dễ dàng tham gia phản ứng cộng với các chất như hidro (H2), halogen (ví dụ: brom Br2, clo Cl2), axit halogenhidric (ví dụ: HCl, HBr) và nước (H2O).
Phản ứng cộng với dung dịch brom:
CH2=CH2 (k) + Br2 (dd) → Br-CH2-CH2-Br (l)
Phản ứng này được dùng để nhận biết etilen.
Phản ứng cộng hidro:
C2H4 + H2 → C2H6 (xúc tác Ni, nhiệt độ)
Sản phẩm của phản ứng này là etan (C2H6).
Phản ứng cộng axit halogenhidric:
CH2=CH2 + HCl (khí) → CH3CH2Cl
CH2=CH2 + HBr → CH3CH2Br
Phản ứng cộng nước:
C2H4 + H2O → C2H5OH (xúc tác H2SO4, nhiệt độ)
Sản phẩm của phản ứng này là etanol (C2H5OH).
Phản ứng trùng hợp
Nhiều phân tử etilen có thể kết hợp với nhau tạo thành một phân tử lớn gọi là polietilen (PE). Phản ứng này gọi là phản ứng trùng hợp:
…+ CH2=CH2 + CH2=CH2 + CH2=CH2 + … → … – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 –… (điều kiện xúc tác, áp suất, nhiệt độ)
Polietilen là một loại nhựa nhiệt dẻo được sử dụng rộng rãi trong sản xuất bao bì, màng phủ và nhiều sản phẩm khác.
Điều chế Etilen
Có hai phương pháp chính để điều chế etilen: trong phòng thí nghiệm và trong công nghiệp.
Điều chế trong phòng thí nghiệm
Trong phòng thí nghiệm, etilen được điều chế bằng cách đun nóng etanol với axit sunfuric đặc (H2SO4) làm chất xúc tác:
CH3CH2OH → CH2=CH2 + H2O (H2SO4, nhiệt độ)
Điều chế trong công nghiệp
Trong công nghiệp, etilen được sản xuất chủ yếu bằng phương pháp cracking các ankan có trong dầu mỏ hoặc khí tự nhiên ở nhiệt độ cao. Một phương pháp khác là tách hidro từ ankan.
Ứng dụng của Etilen
Etilen là một hóa chất công nghiệp quan trọng với nhiều ứng dụng đa dạng:
Trong công nghiệp
- Sản xuất polietilen (PE), một loại nhựa thông dụng.
- Sản xuất etilen oxit, một chất trung gian quan trọng trong sản xuất nhiều hóa chất khác.
- Sản xuất etanol (cồn), một loại nhiên liệu và dung môi.
- Tổng hợp các chất hữu cơ khác như etylen glycol (chất chống đông), vinyl clorua (nguyên liệu sản xuất PVC).
Trong nông nghiệp
- Kích thích quá trình chín của trái cây. Etilen là một hormone thực vật tự nhiên, và việc sử dụng etilen để thúc đẩy quá trình chín của trái cây là một ứng dụng quan trọng trong nông nghiệp.
Trong sinh học
- Etilen ảnh hưởng đến nhiều quá trình sinh lý của thực vật, bao gồm sự nảy mầm, sinh trưởng, ra hoa, và rụng lá.
Phân biệt Etilen với Etan và Axetilen
Để phân biệt etilen với etan và axetilen, có thể sử dụng các thuốc thử khác nhau.
Phân biệt Etilen và Etan
Dùng dung dịch brom (Br2):
- Etilen (CH2=CH2) làm mất màu dung dịch brom.
- Etan (CH3-CH3) không phản ứng với dung dịch brom.
Phân biệt Etilen và Axetilen
Dùng dung dịch bạc nitrat trong amoniac (AgNO3/NH3):
- Axetilen (CH≡CH) phản ứng tạo kết tủa bạc axetilua (CAg≡CAg).
- Etilen (CH2=CH2) không phản ứng.
CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg + 2NH4NO3
Thông qua bài viết này, hy vọng bạn đã có cái nhìn tổng quan và sâu sắc về etilen, đặc biệt là ctct etilen và vai trò của nó trong việc quyết định các tính chất và ứng dụng của chất này. Việc nắm vững kiến thức về etilen không chỉ hữu ích trong học tập mà còn giúp bạn hiểu rõ hơn về các quá trình hóa học diễn ra xung quanh chúng ta.