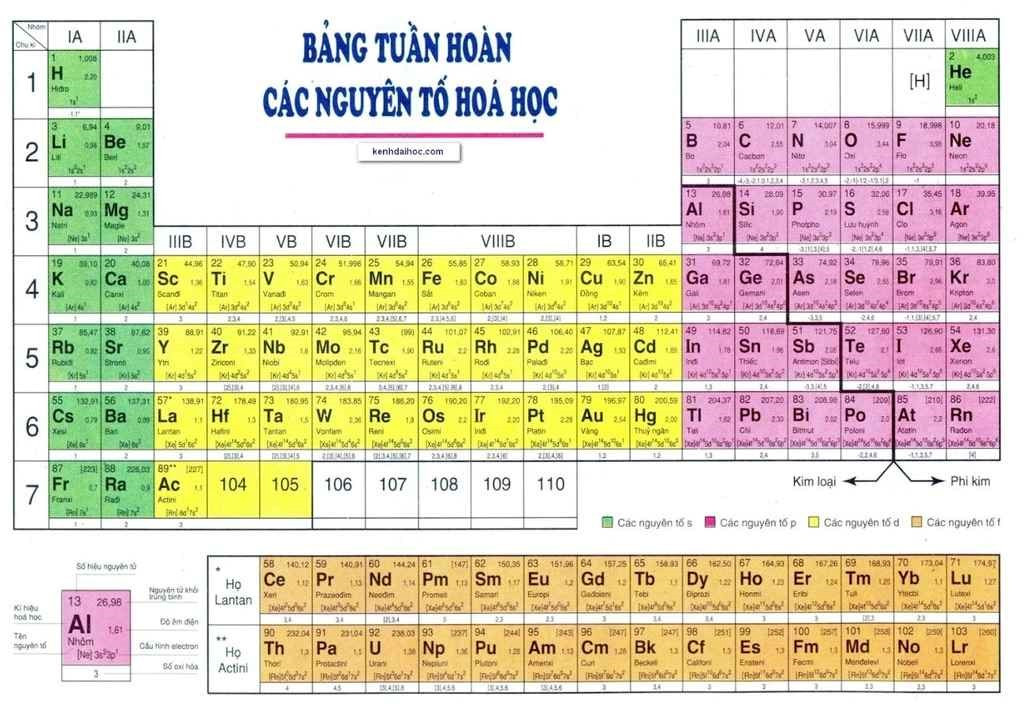
Bảng tuần hoàn hóa học là một công cụ vô cùng quan trọng trong hóa học, đặc biệt là đối với học sinh lớp 7 khi bắt đầu làm quen với môn khoa học thú vị này. Nó không chỉ là một bảng liệt kê các nguyên tố, mà còn là một “bản đồ” giúp chúng ta hiểu được mối quan hệ giữa các nguyên tố và dự đoán tính chất của chúng.
I. Nguyên Tắc Sắp Xếp Các Nguyên Tố Trong Bảng Tuần Hoàn
Bảng tuần hoàn hiện đại được xây dựng dựa trên nguyên tắc sắp xếp các nguyên tố theo chiều tăng dần của điện tích hạt nhân (số proton). Các nguyên tố có tính chất hóa học tương tự nhau được xếp vào cùng một cột (nhóm), và các nguyên tố có cùng số lớp electron được xếp vào cùng một hàng (chu kỳ).
Ảnh chụp toàn cảnh bảng tuần hoàn hóa học, minh họa cách các nguyên tố được sắp xếp theo số hiệu nguyên tử tăng dần.
II. Cấu Trúc Của Bảng Tuần Hoàn
Bảng tuần hoàn bao gồm các thành phần chính sau:
- Ô nguyên tố: Mỗi ô đại diện cho một nguyên tố hóa học và cung cấp các thông tin cơ bản về nguyên tố đó.
- Chu kỳ: Là hàng ngang trong bảng tuần hoàn. Các nguyên tố trong cùng một chu kỳ có cùng số lớp electron.
- Nhóm: Là cột dọc trong bảng tuần hoàn. Các nguyên tố trong cùng một nhóm có tính chất hóa học tương tự nhau do có cấu hình electron lớp ngoài cùng giống nhau.
1. Ô Nguyên Tố
Mỗi ô nguyên tố trong bảng tuần hoàn cung cấp các thông tin sau:
- Số hiệu nguyên tử (Z): Số proton trong hạt nhân của nguyên tử, đồng thời là số thứ tự của nguyên tố trong bảng tuần hoàn.
- Kí hiệu hóa học: Chữ viết tắt đại diện cho tên nguyên tố (ví dụ: H là Hydro, O là Oxi).
- Tên nguyên tố: Tên gọi của nguyên tố.
- Khối lượng nguyên tử: Khối lượng trung bình của một nguyên tử của nguyên tố đó, tính theo đơn vị cacbon (amu).
Hình ảnh cận cảnh ô nguyên tố Carbon (C), làm rõ vị trí và ý nghĩa của số hiệu nguyên tử, ký hiệu hóa học, tên nguyên tố và khối lượng nguyên tử.
2. Chu Kỳ
Bảng tuần hoàn có 7 chu kỳ, được đánh số từ 1 đến 7. Các nguyên tố trong cùng một chu kỳ có cùng số lớp electron. Ví dụ, các nguyên tố trong chu kỳ 2 (Li, Be, B, C, N, O, F, Ne) đều có 2 lớp electron.
Minh họa chu kỳ 2, liệt kê các nguyên tố từ Lithium (Li) đến Neon (Ne) và nhấn mạnh rằng tất cả các nguyên tố này đều có hai lớp electron.
3. Nhóm
Bảng tuần hoàn có 18 nhóm, được chia thành hai loại chính: nhóm A (từ IA đến VIIIA) và nhóm B (từ IB đến VIIIB). Các nguyên tố trong cùng một nhóm A có số electron lớp ngoài cùng giống nhau, do đó có tính chất hóa học tương tự nhau. Ví dụ, các nguyên tố trong nhóm IA (kim loại kiềm) đều có 1 electron lớp ngoài cùng và có tính khử mạnh.
Ảnh so sánh hai nhóm IA (kim loại kiềm) và VIIA (halogen) để làm nổi bật sự khác biệt trong cấu hình electron và tính chất hóa học.
III. Vị Trí Của Kim Loại, Phi Kim Và Khí Hiếm
Bảng tuần hoàn không chỉ sắp xếp các nguyên tố theo tính chất, mà còn giúp chúng ta dễ dàng nhận biết vị trí của các loại nguyên tố khác nhau:
- Kim loại: Chiếm phần lớn bảng tuần hoàn, thường nằm ở phía bên trái và giữa bảng.
- Phi kim: Nằm ở phía bên phải của bảng tuần hoàn.
- Khí hiếm: Nằm ở nhóm VIIIA (nhóm 18) của bảng tuần hoàn.
Hình ảnh trực quan về các kim loại phổ biến và ứng dụng của chúng trong cuộc sống hàng ngày, ví dụ như sắt trong xây dựng, đồng trong dây điện.
IV. Tóm Tắt
Bảng tuần hoàn là một công cụ vô giá cho việc học tập và nghiên cứu hóa học. Việc nắm vững cấu trúc và nguyên tắc sắp xếp của bảng tuần hoàn sẽ giúp các em học sinh lớp 7 dễ dàng hơn trong việc tìm hiểu về thế giới các nguyên tố và các hợp chất hóa học. Bằng cách hiểu rõ hơn về bảng tuần hoàn, các em sẽ có nền tảng vững chắc để tiếp tục khám phá những điều kỳ diệu của hóa học trong tương lai.
Sơ đồ tư duy hóa học hệ thống hóa kiến thức về cấu trúc bảng tuần hoàn, giúp học sinh dễ dàng ghi nhớ và ôn tập.